Er kontaminering av endoskop egentlig et problem?
Flere utbrudd av sykehusinfeksjoner og pseudoinfeksjoner har vært koblet til kontaminerte endoskop enn til noe annet medisinsk utstyr.1
Resultatene av en undersøkelse utført av en senatskomité i USA viser at mellom 2012 og våren 2015 forårsaket endoskop minst 250 livstruende infeksjoner over hele verden, inkludert infeksjoner med superbakterien carbapenem-resistant enterobacteriaceae.2
Kontaminering og utilstrekkelig rengjøring av endoskop er anerkjent av ECRI – en amerikansk ideell organisasjon med fokus på pasientsikkerhet – som et viktig problem for pasientsikkerheten. Derfor har ECRIs årlige liste over "10 viktigste farer ved helseteknologi" inkludert dette problemet kontinuerlig de siste 9 årene.3
Vil du har mer informasjon?
Risiko ved biofilm i gjenbrukbare endoskop
Rutinemessige rengjøringsprosedyrer fjerner ikke biofilm pålitelig fra endoskopkanaler.21
Implementering av infeksjonskontroll via mikrobiologisk overvåking av reprosessering av endoskop er derfor viktig for å oppdage tidlig kolonisering og dannelse av biofilm i endoskopet, og for å forebygge kontaminering og infeksjon hos pasienter etter endoskopiske prosedyrer.22
FDA krever infeksjonskontroll
Den 12. mars 2015 annonserte USAs Food and Drug Administration nye tiltak for å bedre sikkerheten til gjenbrukbart medisinsk utstyr og å gjøre noe med den mulige spredningen av smittestoffer mellom bruk.4, 5, 6
Sikkerhetskommunikasjon om bronkoskop fra FDA
Siden har FDA utgitt en ny veiledning om reprosessering av medisinsk utstyr, arrangert et 2-dagers seminar om overføring av infeksjon i forbindelse med endoskop, gitt produsenter av duodenoskop advarsler på grunn av manglende innsendelse av MDR-rapporter, samt utgitt en sikkerhetskommunikasjon om infeksjon forbundet med reprosesserte fleksible bronkoskop.6
Intervensjoner fra FDA
Mars 2015:
Ny veiledning om reprosessering av medisinsk utstyr
Mai 2015:
2-dagers seminar for å ta tak i problemer med kontaminerte endoskop
August 2015:
Krevde overvåkingsstudier om endoskop etter markedsføring
August 2015:
Advarsler til produsenter av duodenoskop
September 2015:
Sikkerhetskommunikasjon om bronkoskop
November 2016:
To pasienter døde på grunn av et kontaminert bronkoskop i en institusjon i USA7
Januar 2017:
MDR om kontaminerte bronkoskop slår rekorden med 183 MDR-er rapportert til FDA i 2016
Januar 2018:
MDR om kontaminerte bronkoskop slår en ny rekord med 215 MDR-er rapportert til FDA i 2017
Mars 2018:
FDA advarer produsenter av duodenoskop om manglende gjennomføring av overvåkingsstudier etter markedsføring for å vurdere kontaminasjonsrisiko
Kontinuerlig økning i ikke-overholdelse med en standard for infeksjonskontroll som er ment å skulle redusere infeksjonsrisiko
IC.02.02.01 Ikke-overholdelse i sykehus i USA
Joint Commission akkrediterer og sertifiserer nesten 21 000 helseorganisasjoner og -programmer i USA.
Joint Commission Standard IC.02.02.01: Krever at organisasjoner reduserer risikoen for infeksjoner forbundet medisinsk utstyr, enheter og tilbehør. Siden 2009 har det vært en uavbrutt økning i ikke-overholdelse med IC.02.02.01, ettersom utstyr ikke desinfiseres på høyt nivå (HLD) og steriliseres på riktig måte.
"Per i dag har Joint Commission funnet at det mellom 2013 og 2016 var en betydelig økning i antall rapporter om umiddelbar fare for liv (ITL) forbundet med feilaktig sterilisert eller HDL-behandlet utstyr. i 2016 var 74 prosent av alle ITL-er forbundet med feilaktig sterilisert eller HDL-behandlet utstyr."23
Infiserte bronkoskop utgjør en særlig utfordring
Fleksible bronkoskop er vanskelige å rengjøre og desinfisere på grunn av de lange, smale lumenene og tandre materialer. Spørsmålet er om det er mulig å sikre 100 % desinfisering av alle skop. Selv om man følger rengjøringsanvisningene, har man sett vedvarende kontaminering av enheter. Og dersom man ikke følger rengjøringsanvisningene nøye, vil det trolig føre til kontaminerte skop.6, 8
Rutinemessig rengjøring er ikke nok
Den virkelige forekomsten av krysskontaminering og infeksjon under fleksibel bronkoskopi er trolig ikke godt nok kjent, på grunn av underraportering og utilstrekkelig eller ingen overvåking.8, 9
I en oversikt over infeksjoner forbundet med fleksibel bronkoskopi fra 2013, ble 50 studier identifisert. I 30 av de 50 publiserte studiene ble det funnet det samme smittestoffet i både pasienten og i bronkoskopet. Totalt 569 kontaminerte pasienter og 115 smittede pasienter (20,21 %) kunne være direkte forbundet med kontaminerte bronkoskop.8
Rutinemessig rengjøring fjerner ikke biofilm effektivt fra endoskopkanaler. Det fantes biofilm i 13 av 13 endoskop på tross av at riktige rengjøringsprosedyrer ble fulgt i kanalene på 12 av 13 instrumenter.10
På samme måte fant en annen studie mikrobevekst i 32 av 45 endoskop (71 %).17
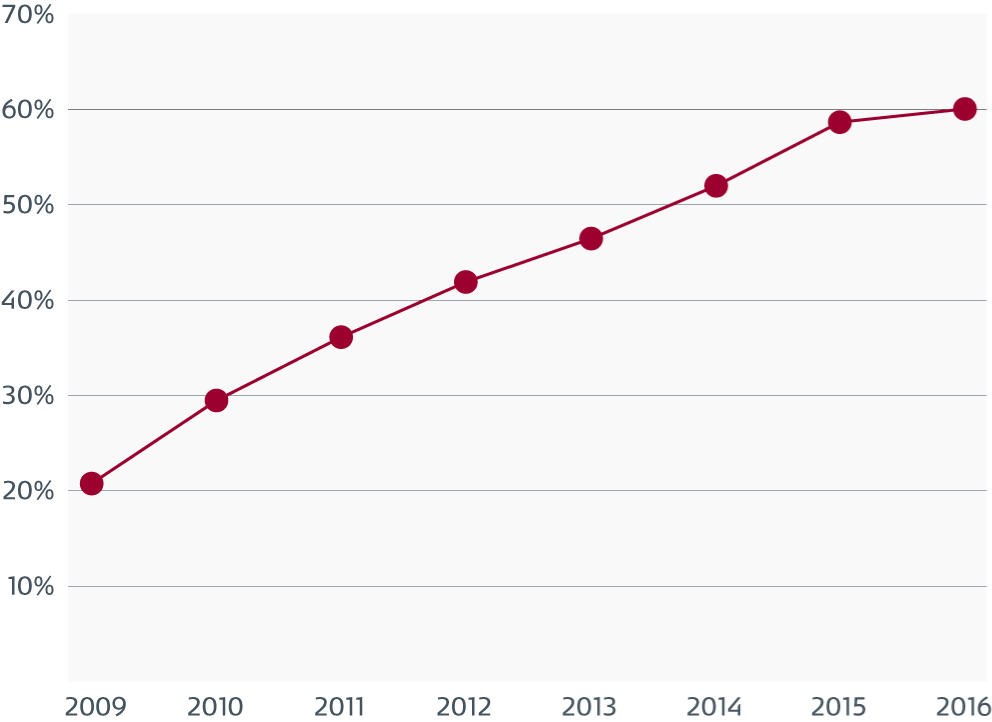
Smuss og mikroorganismer i sugekanaler
Elektronmikrografier av en sugekanal som viser overflatedefekter.
Det biologiske smusset er forbundet med defekter og fester seg også til uskadde områder.

En forstørrelse av et av defektområdene viser smuss og ulike typer mikroorganismer.
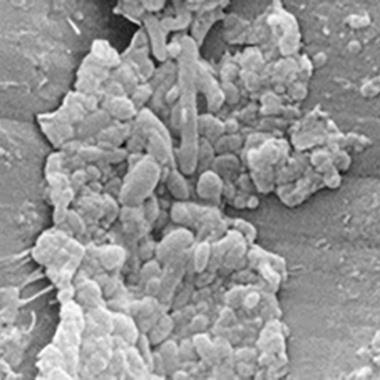
Smuss og biofilm i luft/vann-kanaler
Elektronmikrografier av to ulike luft/vann-kanaler med biofilmer.
Et lavoppløst bilde som viser et sammenløpende lag av smuss og biofilm.
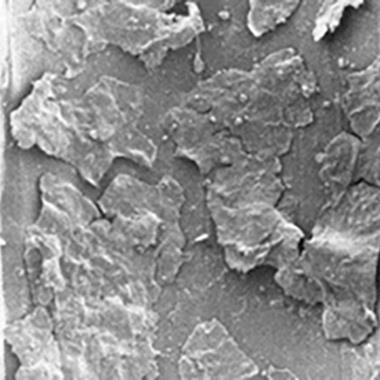
En biofilm med flere lag, som består av celler som ser friske ut, omgitt og overlagt med eksopolysakkarider som ser amorfe ut.

Risikoen for resistente bakteriestrenger øker
Intensivleger, hygienesykepleiere og andre som er involvert i infeksjonskontroll, har vært oppmerksom på risikoen for kontaminering infeksjon av pasienter i medisinsk pleie, i mange år. Nye multi-legemiddelresistente organismer (MDRO) som CRE eller multi-legemiddelresistent Pseudomonas aeruginosa er en ny utfordring når det gjelder risikoene for pasienter, leger, sykehus og klinikker.
Utbrudd av legemiddelresistente organismer forårsaket av gjenbrukbare bronkoskop har vært rapportert.18, 19, 20
Se videoen som viser hvordan bronkoskop utgjør en særlig risiko for krysskontaminering mellom pasienter.
Økonomiske følger av krysskontaminering
En kvantifisering av et systematisk litteratursøk avdekket en generell kontaminering av bronkoskoper på 8,7 % .* Analysen inkluderte 1664 prøver fra 13 studier utført i åtte ulike land.25-37
Ettersom de fleste pasienter som ble smittet av bronkoskop, lider av lungebetennelse8,13, brukes kostnader knyttet til ventilatorassosiert lungebetennelse ($25,149) som den kliniske konsekvensen i beregningen av kostnader. Når man kombinerer den 8 % risikoen for krysskontaminering med den 20,21 % infeksjonsrisikoen, kan kostnaden forbundet med krysskontaminering beregnes:
0,08 x 0,2021 x 25,149 = $407*
*Avhengige kilder, risiko for kontaminering og infeksjon pluss kostnader ved VAP.
8 % risiko for en krysskontaminering25-37 ganger risikoen for en infeksjon (beregning basert på Kovaleva et al.8) ganger kostnaden ved ventilatorassosiert lungebetennelse $25,149.38
I et nylig Pseudomonas-utbrudd ble kostnadene direkte knyttet til diagnostisering, behandling og sykehusinnleggelser for de seks berørte pasientene estimert til $243,000 eller $40,500 per pasient.14

For engangsbruk. Nye muligheter.
Utbrudd har fått leger til å stille spørsmål ved sikkerheten til bronkoskopi. Endoskop, inkludert bronkoskop, er de medisinske enhetene som oftest er forbundet med utbrudd av sykehusinfeksjoner.15, 16
Risikoen for krysskontaminering med multiresistente mikrober i intensivavdeling under bronkoskopiprosedyrer ved sengen kan reduseres betydelig ved bruk av et sterilt engangsbronkoskop.
Ambus aScope 4 Broncho til engangsbruk minimerer risikoen for krysskontaminering ettersom det sikrer sterilitet rett fra pakningen. Dermed unngår man rest-biofilm forårsaket av utilstrekkelig automatisk reprosessering av endoskop.
Referanser
CDC Guideline 2008. Disinfection and Sterilization in Healthcare Facilities.
US senatsrapport 13. januar 2016 Preventable Tragedies: Superbugs and How Ineffective Monitoring of Medical Device Safety Fails Patients
ECRI Institute https://www.ecri.org/Pages/default.aspx
FDA News Release. FDA releases final guidance on reprocessing of reusable medical devices. March 12, 2015.
Reprocessing Medical Devices in Health Care Settings: Validation Methods and Labeling. Guidance for Industry and Food and Drug Administration Staff. FDA. 17. mars 2015.
Gå til artikkelen: Infections Associated with Reprocessed Flexible Bronchoscopes: FDA Safety Communication
Gå til: FDA MAUDE database
Kovaleva et al. 2013; Transmission of Infection by Flexible Gastrointestinal Endoscopy and Bronchoscopy. Clinical Microbiology Rev. April 2013 vol. 26 nr. 2, s. 231-254
MM. Mughal et al.2004; Reprocessing the Bronchoscope: The Challenges, Seminars in Respiratory and Critical Care Medicine. Vol. 25 nr. 4, s. 443-449
Pajkos et al. Is biofilm accumulation on endoscope tubing a contributor to the failure of cleaning and decontamination? Journal of Hospital Infection 2004, 58:224-229.
Terjesen et al. 2017; Early Assessment of the Likely Cost Effectiveness of Single-Use Flexible Video Bronchoscopes
Michelle Alfa Ph.D.; Endoscope Reprocessing Verification Testing, Presentation, Meeting Materials Non-FDA Generated, FDA Committee Meeting, 14.15 mai 2015
R. Douglas Scott II, The Direct Medical Costs of Healthcare-Associated Infections in U.S. Hospitals and the Benefits of Prevention, Division of Healthcare Quality Promotion, National Center for Preparedness, Detection, and Control of Infectious Diseases, Centers for Disease Control and Prevention, March 2009
Kovaleva et al. Usefulness of Bacteriological Monitoring of Endoscope Reprocessing, Therapeutic Gastrointestinal Endoscopy, Chap. 9, p. 141-162, 2011
Srinivasan et al. An Outbreak of Pseudomonas aeruginosa Infections Associated with Flexible Bronchoscopes. The New England Journal of Medicine, 2003; 348;221-7
CDC-utgivelse fra Healthcare Infection Control Practices Advisory Committee (HICPAC) 25. januar 2017. "Essential Elements of a Reprocessing Program for Flexible Endoscopes – Recommendations of the HICPAC”
Cori L. Ofstead et al 2018; Residual moisture andwaterborne pathogens inside flexible endoscopes: Evidence from a multisite study of endoscope drying effectiveness
T. Waite et al 2016; Pseudo-outbreaks of Stenotrophomonas maltophilia on an intensive care unit in England.
Janine Zweigner et al 2014; A carbapenem-resistant Klebsiella pneumoniae outbreak following bronchoscopy
T Agerton et al 1997; Transmission of a highly drug-resistant strain (strain W1) of Mycobacterium tuberculosis. Community outbreak and nosoco- mial transmission via a contaminated bronchoscope.
Ofstead et al 2017: Longitudinal assessment of reprocessing effectiveness for colonoscopes and gastroscopes: Results of visual inspections, biochemical markers, and microbial cultures
Kovaleva and Buss: Usefulness of Bacteriological Monitoring of Endoscope Reprocessing
The Joint Commission: Quick Safety Issue 33 Mai 2017
Ofstead et al. 2018 “Effectiveness of reprocessing for flexible bronchoscopes and endobronchial ultrasound bronchoscopes” CHEST
M. Guy et al. “Outbreak of pulmonary Pseudomonas aeruginosa and Stenotrophomonas maltophilia infections related to contaminated bronchoscope suction valves” Europe's journal of infectious diseases epidemiology, prevention and control Eurosurveillance, Volume 21, Utgave 28, 14. juli 2016
C. Ofstead et al 2016 “Practical toolkit for monitoring endoscope reprocessing effectiveness: Identification of viable bacteria on gastroscopes, colonoscopes, and bronchoscopes.”
Cori L. Ofstead et al. 2018 “Residual moisture and waterborne pathogens inside flexible endoscopes: Evidence from a multisite study of endoscope drying effectiveness.”
P. Batailler et al 2015 “Usefulness of Adenosinetriphosphate Bioluminescence Assay (ATPmetry) for Monitoring the Reprocessing of Endoscopes.”
M. Botana-Rial et al 2016 “A Pseudo-Outbreak of Pseudomonas putida and Stenotrophomonas maltophilia in a Bronchoscopy Unit.”
C. DiazGranados et al 2009 “Outbreak of Pseudomonas aeruginosa Infection Associated With Contamination of a Flexible Bronchoscope”
L. Gavaldà et al 2015 “Microbiological monitoring of flexible bronchoscopes after high-level disinfection and flushing channels with alcohol: Results and costs”
T. Guimarães et al 2016 “Pseudooutbreak of rapidly growing mycobacteria due to Mycobacterium abscessus subsp bolletii in a digestive and respiratory endoscopy unit caused by the same clone as that of a countrywide outbreak”
M. Marino et al 2012 “Is Reprocessing After Disuse a Safety Procedure for Bronchoscopy?”
D. Rosengarten et al 2010 “Cluster of Pseudoinfections with Burkholderia cepacia Associated with a Contaminated Washer ‐ Disinfector in a Bronchoscopy Unit”
N. Shimono et al 2008 “An outbreak of Pseudomonas aeruginosa infections following thoracic surgeries occurring via the contamination of bronchoscopes and an automatic endoscope reprocessor.”
S. Vincenti et al 2014 “Non-fermentative gram-negative bacteria in hospital tap water and water used for haemodialysis and bronchoscope flushing: Prevalence and distribution of antibiotic resistant strains”
T.D. Waite et al “Pseudo-outbreaks of Stenotrophomonas maltophilia on an intensive care unit in England.”
R. Douglas 2009 “The Direct Medical costs of Healthcare-Associated Infections in U.S. Hospitals and the Benefits of Prevention”

